Química en casa
Un espacio para compartir y volver a mirar cuantas veces quieras.
domingo, 5 de agosto de 2018
jueves, 17 de agosto de 2017
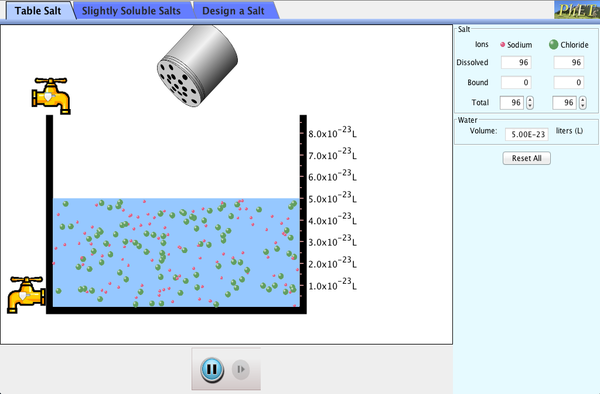
LEYES DE LOS GASES
Después de trabajar con el simulador, resuelve:
1.- Un gas se encuentra a una presión de 2,5 atm. Expresa
este valor en mm de Hg.
2.- A presión de 17 atm, 34 L de un gas a temperatura
constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión
que ejerce?
3.- Aplicando la ley de Boyle-Mariotte, completa la
siguiente tabla y grafíca
|
P(atm)
|
V(l)
|
|
0,25
|
80
|
|
|
50
|
|
1
|
|
|
|
10
|
4.- A 30°C se ejerce una presión de 4 atm sobre un gas
ocupando 20 l. ¿ Qué presión habrá que realizar para que ocupe 16 l.? ¿ y para
que ocupe 40 l.?
5.- A volumen cte., la temperatura de un gas se hace doble o
triple ¿Qué le pasa a su presión?
6.- Aplica la ley de Gay-Lussac y completa la siguiente
tabla. Luego, elabora la gráfica correspondiente.
|
P(atm)
|
T(K)
|
|
1,5
|
300
|
|
|
350
|
|
3
|
|
|
|
650
|
7.- El volumen del aire en los pulmones de una persona es de
615 mL aproximadamente, a una presión de 760 mm Hg. La inhalación ocurre cuando
la presión de los pulmones desciende a 752 mm Hg ¿A qué volumen se expanden los
pulmones?
8.- ¿Qué volumen ocupa un gas a 980 mm Hg, si el recipiente
tiene finalmente una presión de 1,8 atm y el gas se comprime a 860 centímetros
cúbicos?
9.- A volumen constante y a 300 °K un gas realiza una
presión de 2 atm. ¿ Qué presión ejercerá a 45 °C?
10.- Una masa de cierto gas a 100 °C de temperatura ocupa un
volumen de 200 cm3. Si se enfría sin variar su presión hasta 50 °C,
¿qué volumen ocupará?
11.- Es peligroso que los envases de aerosoles se expongan
al calor. Si una lata de fijador para el cabello a una presión de 4 atmósferas
y a una temperatura ambiente de 27 °C se arroja al fuego y el envase alcanza
los 402 °C ¿Cuál será su nueva presión? La lata puede explotar si la presión
interna ejerce 6080 mm Hg. ¿Qué probabilidad hay de que explote?
12.- A presión constante un gas ocupa 1.500 ml a 35º C ¿Qué
temperatura es necesaria para que este gas se expanda 2,6 L?
13.- Un alpinista inhala 500 ml de aire a una temperatura de
10 °C ¿Qué volumen ocupará el aire en sus pulmones si su temperatura corporal
es de 37°C?
14.- ¿Qué volumen ocupa un gas a 30 °C, a presión constante,
si la temperatura disminuye un tercio ocupando 1.200 centímetros cúbicos (c.c.)?
15.- A presión cte. un gas ocupa un volumen de 25 l. Cuando
su temperatura es de 27 °C. ¿Qué volumen ocupará a 320°K?
16.- Se libera una burbuja de 25 ml del tanque de oxígeno de
un buzo que se encuentra a una presión de 4 atmósferas y a una temperatura de
11 °C. ¿Cuál es el volumen de la burbuja cuando ésta alcanza la superficie del
océano, dónde la presión es de 1 atm y la temperatura es de 18 °C?
17.- Cuando un gas a 85º C y 760 mm Hg, a volumen constante
en un cilindro, se comprime, su temperatura disminuye dos tercios (2/3) ¿Qué
presión ejercerá el gas?
18.- Un globo aerostático de 750 ml se infla con helio a 8
°C y a una presión de 380 atmósferas ¿Cuál es el nuevo volumen del globo en la
atmósfera a presión de 0,20 atm y temperatura de 45 °C?
19.- Calcula el volumen que ocupa a 350 K un gas que a 300 K
ocupaba un volumen de 5 L (la presión no varía).
20.- Calcula la presión final de 2 L de gas a 50 °C y 700 mm
de Hg si al final ocupan un volumen de 0,75 L a 50 °C.
domingo, 19 de marzo de 2017
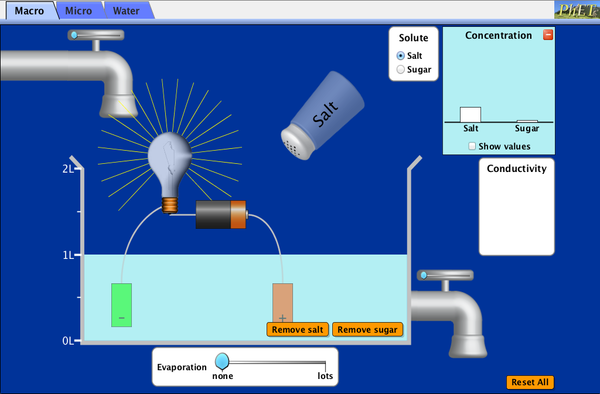
DENSIDAD
Actividad para realizar usando un simulador
Entrar al blog de la profesora: quimicaencasa1.blogspot.com
A la derecha abajo, RECUSOS, ingresar a Densidad (es un simulador)
JUGUEMOS UN RATO
ACTIVIDAD 1
Selecciona a tu derecha
MISMA MASA Introduce cada cubo en la pileta y observa
(TODOS JUNTOS SIN QUE SE TOQUEN) ¿Qué
sucede?
…………………………………………………………………………………………………………………………………
1.
Ahora saca los cubos y toma el volumen de cada
uno: recuerda que el volumen de un cuerpo es igual al volumen del líquido
desplazado.
Ejemplo la pileta tiene un volumen de 100 litros,
cuando esta vacía
Luego le colocas el cuerpo
amarillo hasta el fondo (sostener
el mouse) ahora tiene un volumen
de 110 litros.
Debes hacer la siguiente
cuenta 110 -100 = 10 litros (este es el volumen del cubo amarillo)
REGISTRA LOS VALORES EN ESTA
TABLA
|
CUERPOS
|
MASA
|
VOLUMEN
|
|
|
Amarillo
|
5 Kg
|
10 litros
|
|
|
Azul
|
|
|
|
|
Verde
|
|
|
|
|
Rojo
|
|
|
|
Conclusión:
ACTIVIDAD 2
1.
Selecciona a tu derecha MISMO VOLUMEN
2.
Introduce cada cubo en la pileta y observa
(TODOS JUNTOS SIN QUE SE TOQUEN): ¿qué
sucede?………………………………………………………………………………………………………
3.
Ahora saca los cubos y toma el volumen de cada
uno: recuerda que el volumen de un cuerpo es igual al volumen del líquido
desplazado.
REGISTRA LOS VALORES EN ESTA
TABLA
|
CUERPOS
|
MASA
|
VOLUMEN
|
|
|
Amarillo
|
|
|
|
|
Azul
|
|
|
|
|
Verde
|
|
|
|
|
Rojo
|
|
|
|
Conclusión:
ACTIVIDAD 3
1.
Selecciona a tu derecha MISTERIO Introduce cada cubo en la pileta y observa (TODOS
JUNTOS SIN QUE SE TOQUEN) ¿qué sucede?
…………………………………………………………………………………………………………………………………
2.
Ahora saca los cubos y toma el volumen de cada
uno: recuerda que el volumen de un cuerpo es igual al volumen del líquido
desplazado.
3.
Ahora toma la masa de cada cubo con la balanza.
REGISTRA LOS VALORES EN ESTA TABLA
|
CUERPOS
|
MASA
|
VOLUMEN
|
|
|
Amarillo
|
|
|
|
|
Azul
|
|
|
|
|
Verde
|
|
|
|
|
Rojo
|
|
|
|
|
Violeta
|
|
|
|
Conclusión:
ACTIVIDAD 4
1.
Selecciona a tu derecha A MEDIDA, también selecciona MATERIAL a tu izquierda. Introduce cada cubo
en la pileta y observa ¿qué sucede?
…………………………………………………………………………………………………………………………………
2.
¿Cuál es el volumen? : recuerda que el volumen
de un cuerpo es igual al volumen del líquido desplazado.
3.
Luego mira cuales la masa a tu izquierda.
REGISTRA LOS VALORES EN ESTA TABLA
|
CUERPOS
|
MASA
|
VOLUMEN
|
|
|
MADERA
|
|
|
|
|
HIELO
|
|
|
|
|
ALUMNIO
|
|
|
|
|
LADRILLO
|
|
|
|
Conclusión:
domingo, 23 de agosto de 2015
Ejercitamos ...COMPUESTOS INORGÁNICOS
ENTREGAR EN EL PRÓXIMO
ENCUENTRO
1)
Realiza según el elemento todos
los óxidos posibles. Indica formula y
nombre.
a) S b) Au c) Al d) Ni e) Br
2)
Teniendo en cuenta el ejercicio anterior,
Clasifica teniendo en cuenta si es metal o no metal el tipo de óxido ácido o
básico.
3)
Realizar con los mismos elementos
del ejercicio 1, los hidruros metálicos o no metálicos. Indicar el estado de oxidación
de cada uno.
4) Dar los nombres de los siguientes hidróxidos e
indicar el estado de oxidación de cada
uno.
a) Fe(OH)3 b)
Zn(OH)2 c) K OH
d) Cu(OH)
5) Completar las ecuaciones: da el nombre de cada
compuesto del óxido y del hidróxido.
a)____________+___________------àCa(OH)2
b)____________+___________------àLiOH
c) ____________+___________-----à Al(OH)3
No olvidar de dar los nombre de cada
compuesto.
6)
¿Cómo se forman los oxoácidos?
Completa la ecuación, da el nombre del óxido y del oxoácido.
a)____________+___________------àH2SO2
b)____________+___________------àHNO2
c) ____________+___________-----à HClO4
7) Da las
fórmulas de los siguientes compuestos:
a) Óxido nítrico
b) Hidróxido de potasio
c) Ácido sulfuroso
d) Óxido clórico
8) Realizar la fórmula de Lewis de los compuestos
del ejercicio 5 y 6
Practicamos concentraciones de soluciones
No olvides que la densidad del agua es 1g/cm3
es decir que cada 1g de agua hay 1cm3de
agua. SOLO PARA EL AGUA
1)
Una solución acuosa de jugo
en polvo contiene 10 g
de jugo en 70 g
de solución.
Expresar la concentración de la misma en:
a- g sto / 100g sv ; b- %m/m.
2)
Se disuelven 7 g de cloruro de sodio (sal de
cocina) en 43 cm3 de agua.
Expresar la concentración
de la solución en: a-%m/m; b- g sto / 100cm3 agua.
3)
Calcular a- los g sto cada
100g sc para una sc que contiene 20 g de soluto en 280 g agua.
b- g sto cada
100cm3 sc para una sc que
contiene 45 g
de soluto disueltos en 600 cm3sc.
4)
Se tiene una solución acuosa
de sulfato de amonio al 25 % m/m, es densidad de la sc es 1,14 g/cm³.
Calcular a- la masa de sal para preparar 1000g de sc
b- la masa de
sal para preparar 1000 cm3 de sc.
5)
Se quiere preparar una
solución acuosa de etanol al 33 % v/v. Calcular el volumen de solución que se
puede obtener si se dispone de ½ l de
etanol.
6)
Se disuelven 315 g de ácido nítrico en
2000 cm³ de agua formando una solución.
Calcular a- los g sto cada 100g sc. (%m/m)
b- los g sto
cada 100cm3 sc (%m/v) si la ∂ sc =1,3g/cm3
7) Calcular la
masa de soluto presente en:
a- 1,5 litro de una solución
al 20,7 % m/v .
b- 2,5 litros de una
solución al 9 % m/m (∂ sc = 1,05 g/cm3).
Respuestas:
1) a- 16,66g sto b- 14,28%m/m
2) a-14%m/m
b-16,27g sto
3) a- 6,6%m/m b- 7,5%m/v
4) a- 250g sto b-28,50 g sto
5) 1515 cm3 sc
6) a- 13,6% m/m b- 17,68 %m/v
7) a- 310,5 g sto b- 236,27g sto.
Suscribirse a:
Entradas (Atom)